多肽合成(chéng):二硫鍵形成(chéng)

二硫鍵是很多蛋白質立體結構中不可或缺的組成(chéng)部分。我們幾乎可以在所有的胞外肽類和蛋白質分子中發(fā)現這(zhè)些共價鍵。當一個半胱氨酸的硫原子與位于蛋白質不同位置的另一半胱氨酸的硫原子形成(chéng)共價單鍵時,一個二硫鍵就形成(chéng)了。這(zhè)些鍵有助于穩定蛋白質,特别是那些從細胞中分泌的蛋白質。
一個二硫鍵的有效形成(chéng)涉及多方面(miàn),包括對(duì)半胱氨酸的恰當管理、對(duì)該氨基酸殘基的保護、保護基團的脫除方法和配對(duì)方法等。
如果多肽中隻含有1對(duì)Cys,那二硫鍵的形成(chéng)是簡單的。多肽經(jīng)固相或液相合成(chéng),然後(hòu)在pH8-9的溶液中進(jìn)行氧化。
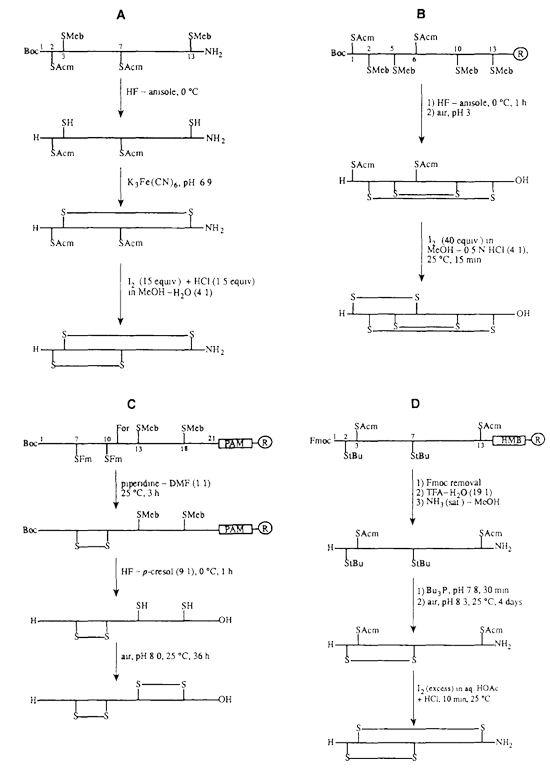
當需要形成(chéng)2對(duì)或2對(duì)以上的二硫鍵時,合成(chéng)過(guò)程則相對(duì)複雜。盡管二硫鍵的形成(chéng)通常是在合成(chéng)方案的最後(hòu)階段完成(chéng),但有時引入預先形成(chéng)的二硫化物是有利于連合或延長(cháng)肽鏈的。使用最廣泛的Cys的保護基團有Bzl、Meb、Mob、tBu、Trt、Tmob、TMTr、 Acm、Npys等。
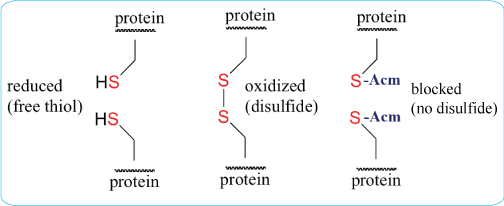
S-acetomidomethyl(Acm)在酸和堿中都(dōu)非常穩定,因此,Acm與Boc和Fmoc化學(xué)成(chéng)份都(dōu)是兼容的。一些保守的半胱氨酸殘基對(duì)蛋白-蛋白結合和蛋白-蛋白相互作用至關重要。部份研究利用Ala替換Cys來破壞二硫鍵結構。另外還(hái)可以利用Acm修飾Cys,這(zhè)種(zhǒng)修飾會阻止二硫鍵的形成(chéng),同時還(hái)保持蛋白中Cys的結構。
S- Acm經(jīng)溶液如醋酸汞((Hg[OAc]2)在pH 4.0的緩沖液中處理1h後(hòu)可被(bèi)去除,從而可獲得自由巯基。或被(bèi)S-Acm-阻斷的多肽可以在苯甲醚存在下,以TFA作爲溶劑,經(jīng)三氟甲烷磺酸銀在0℃處理1h。而在固相合成(chéng)過(guò)程中,當多肽仍然錨定在支撐物上時,經(jīng)Hg(OAc)2 (0.06M)在DMF中于20℃避光條件反應3小時即可,随後(hòu)用DMF和DMF-β-巯基乙醇(9:1,v/v)洗滌,將(jiāng)Hg2 +從被(bèi)解塊的肽-樹脂中去除。
爲什麼(me)半胱氨基(Cys)如此特殊?
- Cys的側鏈有一個非常活躍的反應性巯基。此基團中的的氫原子可很容易地被(bèi)自由基和其他基團取代,因而易與其他分子形成(chéng)共價鍵。
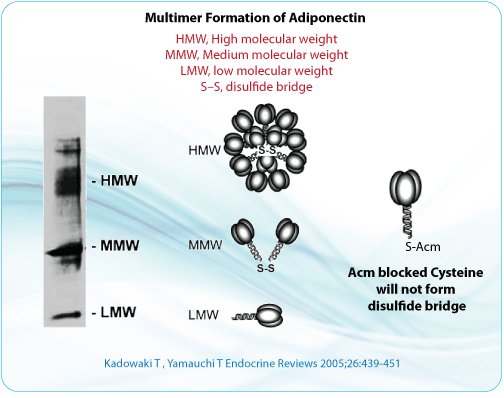
- 二硫鍵是許多蛋白質三維結構中的重要組成(chéng)部分。二硫橋鍵可降低肽的彈性、增加剛度,并減少潛在構象的數量。這(zhè)樣(yàng)的構象限制對(duì)生物活性和結構穩定性來說是至關重要的。它的替換對(duì)蛋白質的整體結構來說將(jiāng)可能(néng)是戲劇性的。
- 疏水性氨基酸如Leu、Ile、Val是螺旋的穩定劑。因爲即使半胱氨酸沒(méi)有形成(chéng)二硫鍵也可以使α螺旋穩定。即如果所有的半胱氨酸殘基處于還(hái)原态(-SH,攜帶自由巯基),高百分比的螺旋片段將(jiāng)有可能(néng)。
- 半胱氨酸形成(chéng)的二硫鍵對(duì)三級結構的穩定來說是持久的。在大多數情況下,鍵間的S-S橋對(duì)形成(chéng)四級結構是必須的。有時形成(chéng)二硫鍵的半胱氨酸殘基在一級結構中相距甚遠。
- 二硫鍵的拓撲是分析蛋白質一級結構同源性的基礎。位于同源蛋白的半胱氨酸殘基是非常保守的。僅色氨酸在統計學(xué)上比半胱氨酸更爲保守。
- 半胱氨酸位于巯基酶催化部位的中心。半胱氨酸可直接與底物形成(chéng)酰基中間體。還(hái)原形态作爲“巯基緩沖器”維持著(zhe)蛋白中的半胱氨酸處于還(hái)原态。在低的pH值時,平衡偏向(xiàng)還(hái)原态,-SH形式,而在堿性環境下,-SH更傾向(xiàng)于被(bèi)氧化,形成(chéng)-SR,而 R是除氫原子外的任何物質。
- • 半胱氨酸也可作爲解毒性與過(guò)氧化氫和有機過(guò)氧化物反應。
多重二硫鍵形成(chéng)方案
報價
- 方法 1: 在線報價系統:

|



