多肽和蛋白的相互作用
檢測與某一多肽相互作用的物質,最簡單的方法就是利用此多肽做親和pull-down實驗,然後(hòu)直接檢測結合蛋白。蛋白質體外結合(Pull-down)試驗可用于驗證蛋白-蛋白相互作用的存在(經(jīng)由别的研究方法預測過(guò)的,如免疫共沉澱)和作爲一種(zhǒng)初級的篩選試驗來識别一些未知的蛋白-蛋白相互作用。通過(guò)競争性阻斷結合,合成(chéng)肽通常被(bèi)用來驗證被(bèi)假設的蛋白質-蛋白質相互作用。
生物素标記肽含有一個特殊的功能(néng)區和相當于參照的未修飾肽,此肽可被(bèi)錨定在親和素共轭的磁珠上,將(jiāng)這(zhè)些磁珠與目标樣(yàng)本共同孵育(如核提取物或純化的重組蛋白),通過(guò)洗滌去除未結合的蛋白,然後(hòu)洗脫結合的蛋白質, SDS/ PAGE分析,經(jīng)蛋白染色即可直接觀察。通過(guò)比較分别與修飾和未修飾多肽相結合的蛋白質,即有可能(néng)确定候選者,即特定功能(néng)蛋白的“reader”蛋白。
帶有一些特殊修飾的生物素标記肽可以通過(guò)化學(xué)合成(chéng),純度達80%以上。肽長(cháng)度應該在15-20個氨基酸。目标修飾位于序列中間時,兩(liǎng)翼氨基酸殘基不能(néng)少于6-8個。一般情況下,生物素多被(bèi)偶聯在N末端或C末端。如果無特殊要求,我們建議生物素偶聯至N-末端,其優勢是修飾的成(chéng)功率更高,生産的時間更短,并且易于操作。此外,如果偶聯至C-末端,需要額外增加一個賴氨酸。
生物素标記肽的Pull-down實驗方案
生物素标記肽可與親和素磁珠共轭以生成(chéng)樹脂,用于肽pulldown試驗。先把生物素标記肽上樣(yàng)至Immobilized streptavidin beads (Pierce) 錨定有親和素的磁珠上,再與細胞裂解液孵育。細胞裂解于1%(v/v)Nonidet P-40, 150 mM sodium chloride, 50 mM Tris-HCl, pH 7.5, protease inhibitors (Complete Tablets, Roche Applied Science),
加入 1 mM sodium orthovanadate作爲磷酸酶抑制劑。等量的蛋白質分别與被(bèi)錨定的多肽在4℃孵育6小時。經(jīng)過(guò)大量洗滌,在SDS樣(yàng)品buffer中煮沸,結合蛋白可從被(bèi)錨定的多肽洗脫下來,或者,用50 mM dithiothreitol將(jiāng)多肽與蛋白複合物從磁珠中斷開(kāi)。將(jiāng)來自活性肽和對(duì)照目标肽pull-downs的洗脫液合并,以作進(jìn)一步的分析。
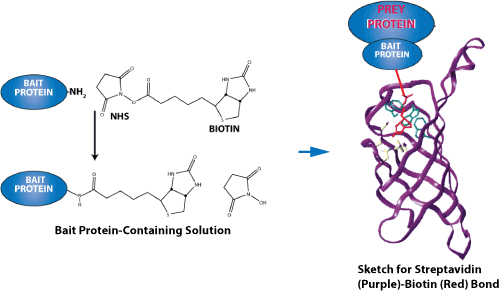
上圖爲鏈黴親和素-生物素鍵力測量示意圖。由于它們異常高的親和結合性,其中最突出的配體-受體對(duì)是鏈黴親和素-生物素(streptavidin-biotin)和親和素-生物素(avidin-biotin)。 這(zhè)兩(liǎng)種(zhǒng)蛋白質都(dōu)有一個四聚體的結構,這(zhè)樣(yàng)他們可以結合4個配體。
|



