| |
FAM-labelled MsSSB-Ct peptides were synthesized by LifeTein LLC.
TAMRA labeled CD81 peptides were synthesized by LifeTein LLC.
Biotinylated RON2 peptide were synthesized by LifeTein LLC.
|
| |
多肽熒光标記: FITC, FAM, TAMRA, Biotin, EDANS/Dabcyl...
熒光染料是生物分子标記的重要工具。熒光素衍生物可被(bèi)廣泛地标記在那些用于熒光顯微鏡、流式細胞儀和免疫熒光檢測等領域的試劑上。
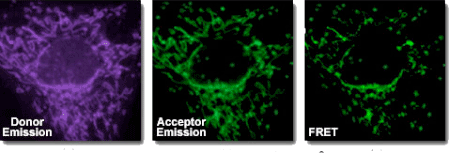
- FRET Assay
- FITC
- FAQs
- 成(chéng)功案例
熒光共振能(néng)量轉移(Fluorescence resonance energy transfer, FRET)
熒光共振能(néng)量轉移(FRET)是一種(zhǒng)非輻射能(néng)量躍遷,通過(guò)分子間的電偶極相互作用,將(jiāng)供體激發(fā)态能(néng)量轉移到受體激發(fā)态的過(guò)程。此過(guò)程沒(méi)有光子的參與,所以是非輻射的。該分析方法具有快速、敏感和簡單等優點。
用于FRET試驗的染料是可以相同的。但在大多數應用中其實是使用不同的染料。簡單地說,熒光共振能(néng)量轉移是在供體基團的激發(fā)狀态下由一對(duì)偶極子介導的能(néng)量從供體(染料1)向(xiàng)受體(染料2)轉移的過(guò)程。通常,供體 (Donor)熒光基團的發(fā)射光譜要與受體(Acceptor)基團的吸收光譜有一定的重疊。當這(zhè)兩(liǎng)個熒光基團間的距離合适時(10 – 100 Å)),就可觀察到熒光能(néng)量由供體向(xiàng)受體轉移的現象。能(néng)量轉移發(fā)生方式依賴于受體的化學(xué)結構:
- a) 被(bèi)轉化爲分子的振動,即發(fā)生能(néng)量轉移熒光熄滅。(受體是猝光劑)
- b) 發(fā)射更強于受體本身的特征熒光,造成(chéng)次級熒光光譜的紅移。 (受體是熒光發(fā)射體)。
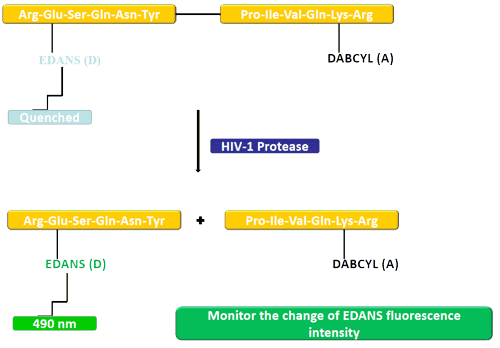
一個供體基團(EDANS)和接受基因(DABCYL)勻被(bèi)連接到一HIV蛋白酶的天然底物上,當該底物未被(bèi)切斷時,DABCYL可淬滅EDANS,從而檢測不到熒光。當該底物被(bèi)HIV-1蛋白酶切斷後(hòu),EDANS不再被(bèi)DABCYL淬滅,随即可檢測到EDANS熒光。蛋白酶抑制劑的有效性可憑借EDANS熒光強度的變化進(jìn)行監測。
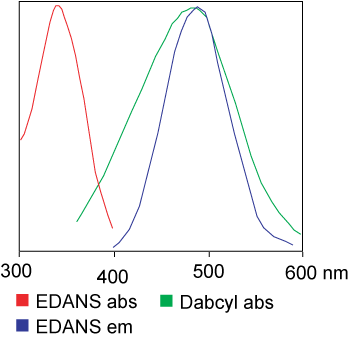
FRET肽是研究肽酶特異性的便利工具,由于其反應過(guò)程可被(bèi)連續監測,爲酶活性的檢測提供了一個便捷的方法。供體/受體對(duì)的肽鍵水解後(hòu)産生的熒光可衡量納摩爾級濃度的酶活性。當FRET肽是完整的,表現出的是内部的熒光猝滅,但當供體/受體對(duì)的任何肽鍵斷裂就會釋放出熒光,此熒光可被(bèi)連續檢測,從而可對(duì)酶的活性進(jìn)行定量分析。
FRET 肽可作爲各類酶研究的合适底物,比如:
- 肽酶、蛋白酶、激酶、磷酸酶的動力特征和功能(néng)特征。
- 對(duì)新的蛋白水解酶的篩選和檢測。
- 對(duì)多肽折疊的構象研究。
以下是一些用于FRET的标準染料組合::
- Fluorescein and Dabcyl:FAM/Lys(Dabcyl)
- Fluorescein and Tamra: FAM/TAMRA
- Methoxy-coumarin-acetic-acid(MCA) and 2,4-Dinitrophenyl(DNP): MCA/Lys(Dnp).
- Ortho-aminobenzoic acid (Abz) and 2,4-dinitrophenyl (Dnp) or N-(2,4-dinitrophenyl)ethylenediamine (EDDnp): Abz/Tyr (NO2), Abz/EDDnp
- Dabcyl and Glu(EDANS)
在蛋白酶的多肽底物内經(jīng)共振能(néng)量轉移引發(fā)熒光猝滅的供體-接受對(duì)
|
波長(cháng)(nm) |
猝滅劑 |
熒光團 |
激發(fā)波 |
發(fā)射波 |
|
Dabcyl
Dansyl
DNP
DNP
DNP
Tyr (NO2) |
Edans
Trp
Trp
MCA
Abz
Abz |
336
336
328
328
328
320 |
490
350
350
393
420
420 |
常規RET供體-接受對(duì)的福斯特臨界距離(Forster Critical Distance)
Donor |
Aceptor |
Forster Distance
(Nanometers) |
|
Tryptophan
IAEDANS (1)
BFP
Dansyl
Dansyl
CFP
CF (3)
Fluorescein
Cy3
GFP
BODIPY FL (4)
Rhodamine 6G
FITC
B-Phycoerythrin
Cy5 |
Dansyl
DDPM (2)
DsRFP
FITC
Octadecylrhodamine
GFP
Texas Red
Tetramethylrhodamine
Cy5
YFP
BODIPY FL (4)
Malachite Green
Eosin Thiosemicarbazide
Cy5
Cy5.5 |
2.1
2.5-2.9
3.1-3.3
3.3-4.1
4.3
4.7-4.9
5.1
4.9-5.5
>5.0
5.5-5.7
5.7
6.1
6.1-6.4
7.2
>8.0 |
(1): 5-(2-iodoacetylaminoethyl)aminonaphthalene-1-sulfonic acid
(2): N-(4-dimethylamino-3,5-dinitrophenyl) maleimide
(3): carboxyfluorescein succinimidyl ester
(4): 4,4-difluoro-4-bora-3a, 4a-diaza-s-indacene
|
|
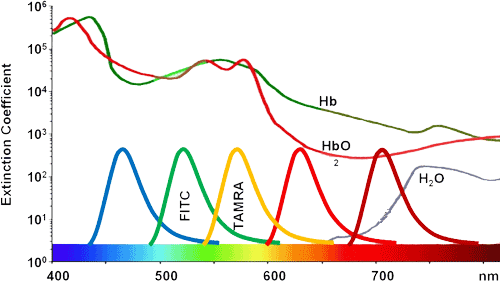
異硫氰酸熒光素(FITC)與羧基熒光素相比更具活性,而且後(hòu)者需要被(bèi)激活才能(néng)使用。FITC主要是與巯基反應,如還(hái)原型半胱氨酸的側鏈,尤其是多肽或蛋白中的氨基。
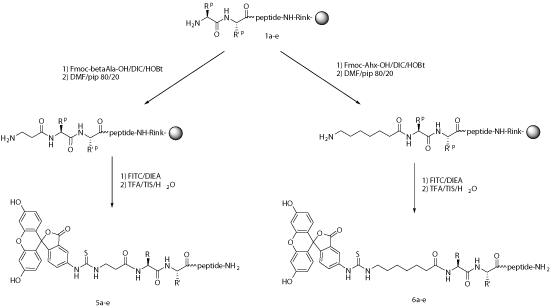
對(duì)衆多應用來說,在化學(xué)合成(chéng)過(guò)程中引入熒光标記是很容易的。 如在固相合成(chéng)過(guò)程中,FITC可以與賴氨酸(Lys)或被(bèi)選擇性地脫保護的鳥氨酸(ornithine)側鏈,或合成(chéng)過(guò)程中的多肽N端氨基反應。當在N端标記時,建議在最後(hòu)一個氨基和由異硫氰酸酯與氨基反應産生的硫脲鍵之間引入烷基間隔器(alkyl spacer),如氨基己酸(Ahx)。
鏈接切割需要酸性環境,在N端标記FITC的多肽需經(jīng)曆環化作用來形成(chéng)熒光素,通常會伴有最後(hòu)一個氨基酸的去除,但當有一個間隔器如氨基己酸,或者是通過(guò)非酸性環境將(jiāng)目的肽從樹脂上切下來時,這(zhè)種(zhǒng)情況可避免。
空間位阻被(bèi)認爲是在熒光染料前使用Ahx的主要原因,而不是爲什麼(me)FITC不能(néng)直接偶聯在多肽上的原因。Ahx或b-Ala均可作爲間隔器用于FITC标記的多肽上。
通常,生物素、FITC等染料可任意标記在多肽N端或C端。但我們推薦N端标記,其成(chéng)功率更高、所需時間更短、更易操作。由于多肽都(dōu)是從C端往N端合成(chéng),所以N端修飾將(jiāng)是固相合成(chéng)的最後(hòu)一步,不再需要額外的偶聯步驟。相反,如果是C端标記,則需要附加步驟,而過(guò)程會更複雜。
大多數染料都(dōu)是大型的芳香分子,如此龐大分子的介入有助于避免标簽和多肽之間的相互作用。這(zhè)將(jiāng)有助于保持多肽的構象和生物學(xué)活性。一般來說,推薦引入一個柔性間隔如Ahx(一個6碳化合物)會使熒光标記更加穩定。否則FITC將(jiāng)很容易與其他任何位置的半胱氨酸的巯基或賴氨酸的氨基發(fā)生連接。
| Probe |
Ex (nm) |
Em (nm) |
MW |
Notes |
| Methoxycoumarin (MCA) |
360 |
410 |
317 |
Succinimidyl ester |
| Fluorescein (FITC) |
495 |
519 |
389 |
FITC; pH sensitive |
| X-Rhodamine |
570 |
576 |
548 |
XRITC |
| Lissamine Rhodamine B |
570 |
590 |
|
|
點擊查看
澤溪源熒光列表,包括吸收峰和發(fā)射峰 |
成(chéng)功案例1
這(zhè)個事(shì)例闡述了用于FRET檢測的基本方法。熒光分子methoxycoumarine acetic acid(MCA)被(bèi)标記在多肽的N端,該多肽被(bèi)設計作爲及基質金屬蛋白酶溶基質素的底物,在易斷裂的Gly-Leu肽鍵(可被(bèi)酶水解)之後(hòu),連接猝滅劑N-3-(2, 4-dinitrophenyl)-L-2,3-diaminopropionyl(DPA)(Knight el al., 1992)。
完整多肽序列如下:
MCA-Pro-Leu-Gly-Leu-DPA-Ala-Arg-NH2
MCA的最大吸收峰是328nm,最大發(fā)射峰是393nm。 DPA基團在363nm處有很強的吸收譜,并在410nm處有明顯的肩峰。該肩峰與MCA熒光譜重疊,從而導緻了顯著的熒光猝滅。
研究發(fā)現,1μm MCA-Pro-Leu(酶解産物)溶液的熒光量是等量MCA-Pro-Leu-Gly-Leu-DPA-Ala-Arg-NH2溶液的130倍,其激發(fā)波和發(fā)射波分别爲328nm、 393nm。
多肽酶解導緻了MCA與DPA基團的分裂,因而MCA熒光大大地增強。熒光增強可随著(zhe)時間變化地跟蹤,并可以此度量反應速度,研究者借此可以确立該肽作爲幾個及基質金屬蛋白酶家族成(chéng)員的底物的Kcat/Km值。此檢測方法最近被(bèi)用來測定溶基質素的潛在抑制能(néng)力,即通過(guò)酶反應的初速度來衡量抑制效果 (Copeland et al., 1995)。
成(chéng)功案例2
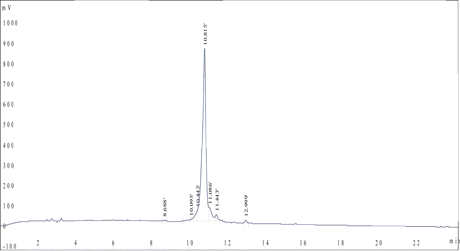
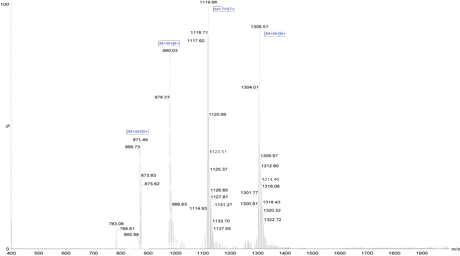
客戶定制了一個疏水性很高的68aa多肽(純度>85%),同時熒光素FITC被(bèi)标記在該多肽的N端。此多肽合成(chéng)僅花了4周時間。
HPLC 分析:
MS 分析:
|
多肽熒光标記、熒光修飾報價:
- 方法一: 通過(guò)在線的報價系統

|



